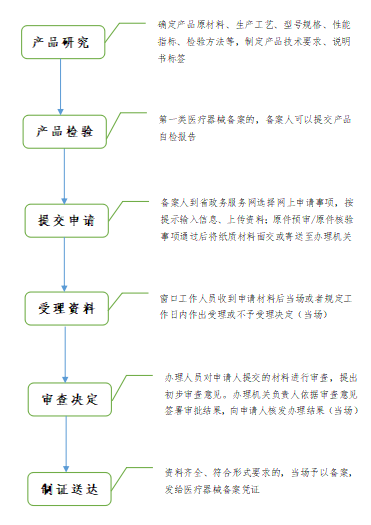
第一类医疗器械备案流程
注:国家对医疗器械按照风险程度实行分类管理。实行备案的医疗器械为第一类医疗器械产品目录和相应体外诊断试剂分类子目录中的第一类医疗器械。备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料。进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案资料。
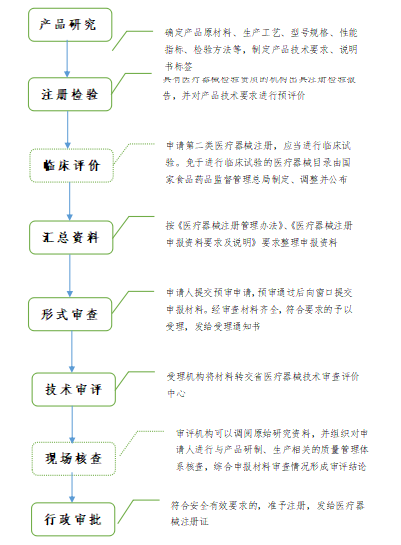
第二类医疗器械注册流程
注:国家对医疗器械按照风险程度实行分类管理。第二类医疗器械实行产品注册管理。申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市药品监督管理局提交注册申请资料。
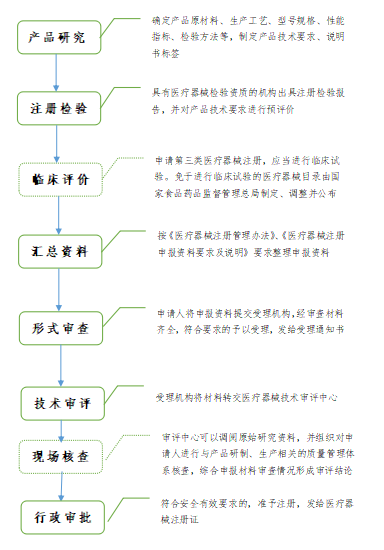
第三类医疗器械注册流程
注:国家对医疗器械按照风险程度实行分类管理。第三类医疗器械实行产品注册管理。申请第三类医疗器械产品注册,注册申请人应当向国家药品监督管理局提交注册申请资料。
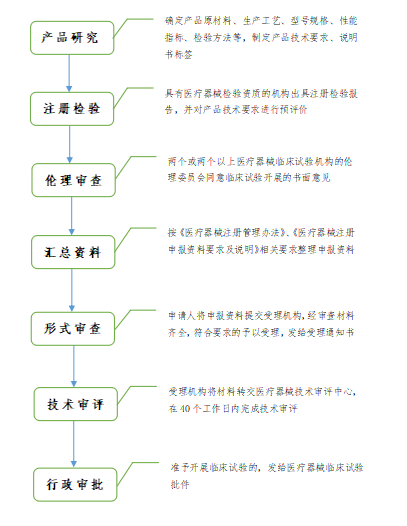
第三类医疗器械临床试验申报流程
第三类医疗器械进行临床试验对人体具有较高风险的,应当经国家药品监督管理局批准。需进行临床试验审批的第三类医疗器械目录由国家药品监督管理局制定、调整并公布。
临床试验审批是指国家药品监督管理局根据申请人的申请,对拟开展临床试验的医疗器械的风险程度、临床试验方案、临床受益与风险对比分析报告等进行综合分析,以决定是否同意开展临床试验的过程。
 北京奥达康医药科技有限责任公司
北京奥达康医药科技有限责任公司

